各種アポトーシスアッセイ
 |
NucleoCounter NC-3000™システムは以下のアポトーシスアッセイに対応しております。
 DNA断片化 |
 カスパーゼアッセイ |
 アネキシンVアッセイ |
 ミトコンドリア膜電位アッセイ |
はじめに
アポトーシスの信頼性の高い検出と測定は、アポトーシス関連疾患の治療法の開発およびアポトーシス機構全般の研究に不可欠であり、多くの方法が開発されています。 アポトーシスの検出における主要な問題の1つは、アポトーシスと壊死のプロセスの多くの特徴が重複するため、最終的な結論を出す前にいくつかの独立したアッセイを使用する必要があることです。各メソッドには利点と制限があり、一部のアプリケーションには適しているものも他のアプリケーションには適していない場合があります。
DNA断片化
NucleoCounter®NC-3000™を使用した後期アポトーシス評価特徴
◆ 1 つの簡単なステップでの取得と分析
◆ プリセットされた設定によるユーザーフレンドリーなプロトコル
◆ RNase処理不要
◆ キャリブレーション不要
◆ プロットマネージャー機能による明確なデータ表示
◆ 自動 PDFレポート
◆ FCS/ACS形式でデータをエクスポート
DNA断片化アッセイの概要
アポトーシスの間、タンパク質は染色体 DNA に作用して、DNA を断片化します。この後期アポトーシスイベントは、Cell Cycleアッセイと同様の方法で DNA 含有量を測定することによって検出されます。アポトーシス細胞では、G1 期と G2 期のピークの溶解と、染色体 DNA の断片化の進行とともに「サブG1ピーク」の上昇が見られます。DNA分解のメカニズムは、アポトーシスの進行に伴うカルシウムおよびマグネシウム依存性ヌクレアーゼの活性化です。その結果、DNA 内には断片化の原因となるニックや二本鎖切断が存在します1。これは後期アポトーシス イベントであり、細胞の DNA 含有量を定量化することで検出できます。後期アポトーシス細胞は、DNA含有量が少ないため、サブG1期にあると識別できます。
アッセイ原理
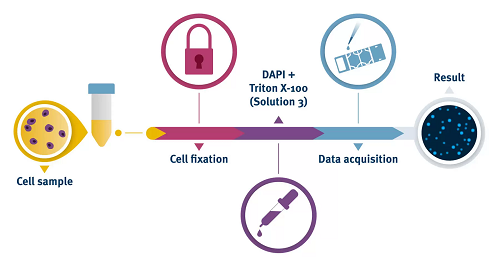
NucleoCounter®NC-3000™システムは、蛍光顕微鏡と画像分析を使用して、断片化されたDNAを持つ細胞(サブG1細胞)の検出を自動化します。 固定細胞のDAPI染色後、サンプルはNucleoCounter®NC-3000™システムを使用して分析され、細胞蛍光が定量化され、断片化されたDNAを持つアポトーシス細胞は、PC画面に表示されるDNA含有量ヒストグラムのサブG1ピークとして見られます。ヒストグラムのマーカーを使用して、アポトーシス細胞を区別できます。結果はプロットマネージャーで表示されます。
プロット マネージャーに表示される結果
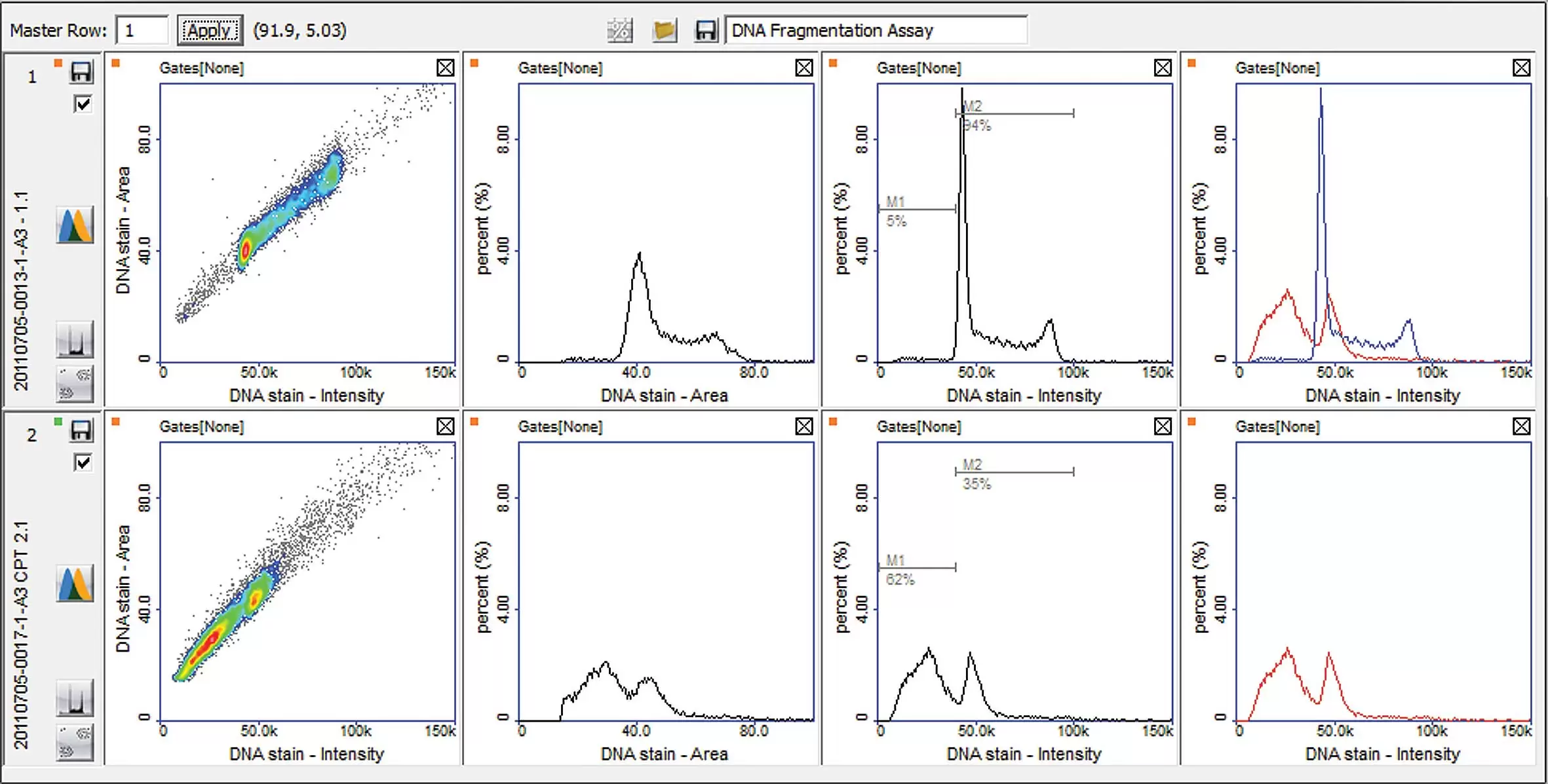
図:Jurkat細胞をカンプトテシンの非存在下(上列)または存在下(下列)で増殖させ、DNAフラグメンテーションアッセイとNucleoCounter®NC-3000™を使用して細胞を分析しました。
散布図とヒストグラムは、NucleoView™NC-3000™ソフトウェアから取得しました。 表示されたヒストグラムのマーカーを使用して、断片化されたDNAを持つセル(Sub-G1セル)を区別しました。 色付きのヒストグラムは、未処理(青線)とカンプトテシン処理(赤線)のサンプルのマージです。
消耗品
| 品番 | 品名 | 容量 | 用途 |
|---|---|---|---|
| 942-0001 | NC‐Slide A2 | 25枚 | 全アッセイ共通(NC-250・NC-3000) |
| 942-0003 | NC‐Slide A8 | 25枚 | 全アッセイ共通(NC-250・NC-3000) |
| 910-3003 | Solution 3 | 25mL | DNA fragmentationアッセイ Cell Cycle アッセイ(固定プロトコール) |
カスパーゼアッセイ (Caspase 3/7, 8, 9 Assay)
FLICA アッセイを使用したアポトーシスの検出特徴
◇ プリセット設定によるユーザーフレンドリーなプロトコル
◇ 細胞レベルで特定のカスパーゼ活性を定量化
◇ 細胞がアポトーシス/ネクローシスの初期段階または後期段階にあるかどうかを確認する
◇ 高速で自動化された細胞分析
◇ プロット マネージャー機能による明確なデータ表示
◇ 自動 PDF レポート
◇ FCS/ACS 形式でデータをエクスポート
概要
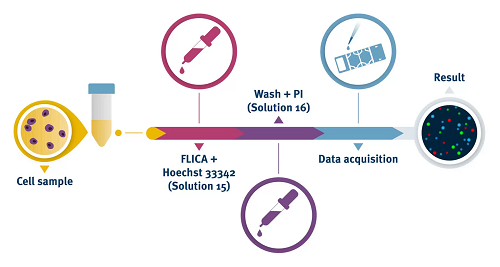
カスパーゼ (システイン-アスパラギン酸プロテアーゼ、システイン アスパルターゼまたはシステイン依存性アスパラギン酸指向性プロテアーゼ) は、プログラムされた細胞死の実行に不可欠なプロテアーゼ酵素のファミリーです。これらはアポトーシスプロセスの主な実行者です。活性化されると、カスパーゼは特定の基質のタンパク質分解によってアポトーシスを媒介します。このアッセイでは蛍光プローブに結合したカスパーゼ特異的阻害配列を使用して活性を測定します。このように測定された蛍光は、生きている細胞全体の活性カスパーゼの量を直接測定します。死細胞は、ヨウ化プロピジウム (PI) 染色により識別されます。このアッセイは、Fluorochrome-Labeled Inhibitor of Caspases Assay(FLICA)として知られています。
原理
 NC-3000を利用したカスパーゼ アポトーシス アッセイ (FLICA) を使用する場合、カスパーゼ活性は、蛍光プローブに結合したカスパーゼ特異的阻害配列で測定されます。
NC-3000を利用したカスパーゼ アポトーシス アッセイ (FLICA) を使用する場合、カスパーゼ活性は、蛍光プローブに結合したカスパーゼ特異的阻害配列で測定されます。細胞毒性のないカスパーゼ特異的阻害剤は細胞透過性であり、無傷の原形質膜を通過し、そこで活性化カスパーゼヘテロ二量体の大きなサブユニットの反応性システイン残基に共有結合します。未結合のカスパーゼ阻害剤は細胞外に拡散して洗い流され、プロカスパーゼや酵素の不活性型による干渉はありません。したがって、測定された蛍光は、生細胞全体の活性化カスパーゼの量を直接定量化します。死細胞は、PI を使用して識別されます。
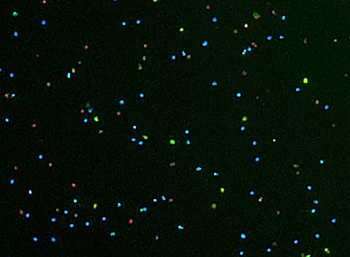
NucleoCounter®NC-3000™システムは、蛍光顕微鏡と画像解析を使用して、カスパーゼ活性に基づくアポトーシス細胞の検出を自動化します。細胞はヘキスト 33342、PI、およびカルボキシフルオレセイン標識 FLICA 試薬で染色されます。 カスパーゼアッセイのデータ画像 全細胞集団はHoechst 33342 (青) で染色され、初期アポトーシス細胞と後期アポトーシス/ネクローシス細胞は、それぞれカルボキシフルオレセイン標識 FLICA 試薬 (緑) と PI (赤) で染色されます。
プロットマネージャーに表示される結果
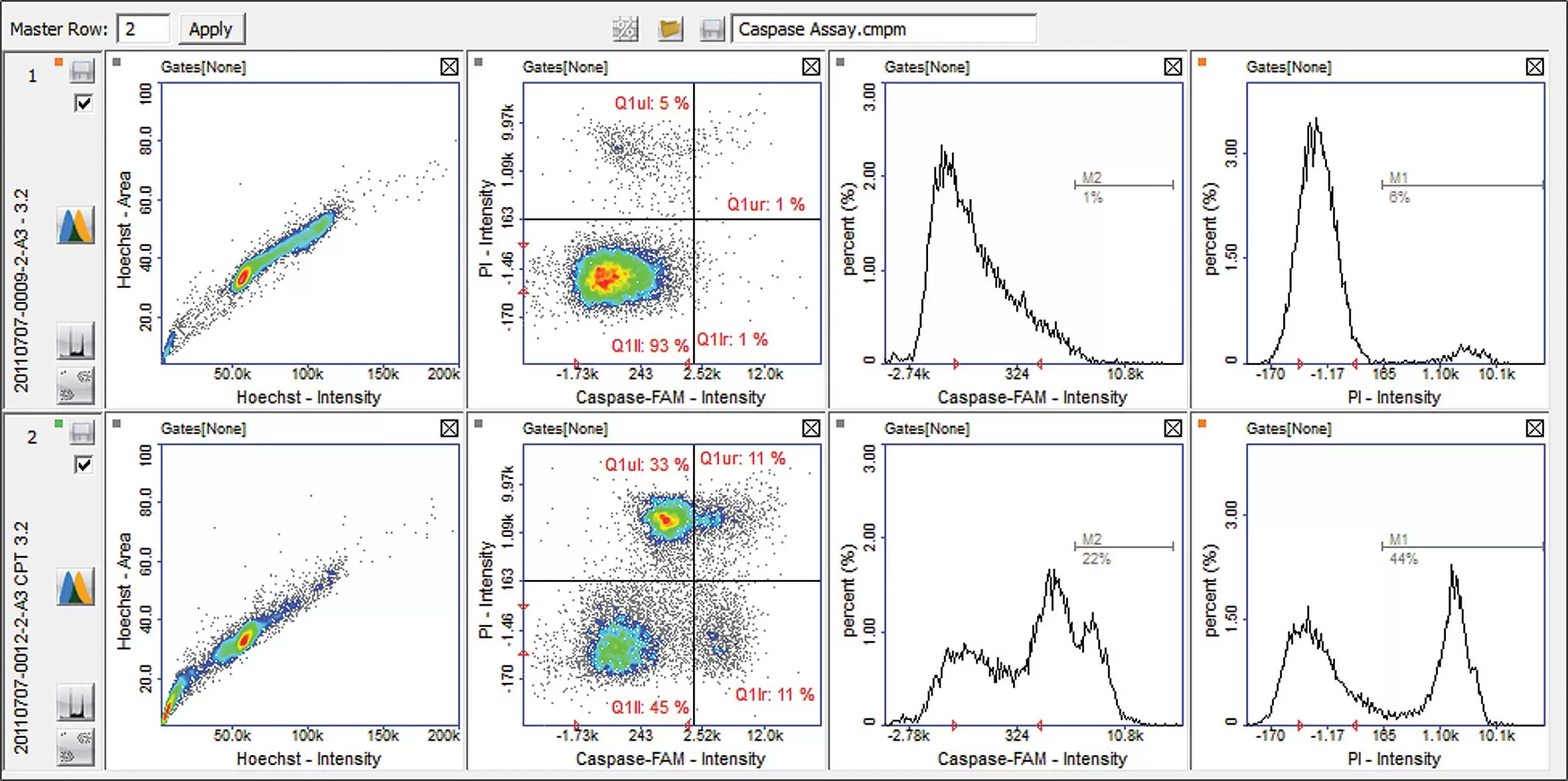
上の図は、培養中のJurkat細胞にカンプトテシン (CPT) を添加した際の効果を示しています。CPT は一般的に使用されるトポイソメラーゼ毒であり、アポトーシスを誘導し、カスパーゼを活性化します。Jurkat 細胞は、潜在的な抗がん化合物の有効性を研究するために一般的に使用される、ヒト T細胞の細胞株です。
Jurkat細胞は、カンプトテシン (CPT) の非存在下 (上段) または存在下 (下段) で増殖させました。細胞をHoechst 33342、FLICA試薬 (FAM) および PIで染色し、NucleoCounter®NC-3000™ を用いたカスパーゼ 3/7、8、または 9 アッセイを使用して分析しました。NucleoView™NC-3000™ソフトウェアで散布図とヒストグラムを取得しました。表示されたプロットのポリゴンとマーカーは、さまざまな細胞集団を区別するために使用されました。この例では、CPTによって初期アポトーシス細胞が著しく増加しました (2 番目のプロットの右下のクアドラントにカスパーゼ FAM 陽性および PI 陰性細胞としてマークされています)。
消耗品
| 品番 | 品名 | 容量 | 用途 |
|---|---|---|---|
| 942-0001 | NC‐Slide A2 | 25枚 | 全アッセイ共通(NC-250・NC-3000) |
| 910-3015 | Solution 15 | 1mL | Annexin V・Caspase・GFP Transfection |
| 910-3016 | Solution 16 | 1mL | Annexin V・Caspase・GFP Transfection |
アネキシンVアッセイ
アネキシンV と NucleoCounter®NC-3000™を使用したアポトーシスの検出特徴
◇ 高速で自動化された単一細胞分析
◇ 異なるユーザー間でも標準化された結果
◇ プリセット設定によるユーザーフレンドリーなプロトコル
◇ キャリブレーション不要
◇ プロットマネージャー機能による明確なデータ表示
◇ 自動 PDFレポート
◇ FCS/ACS 形式でデータをエクスポート
概要
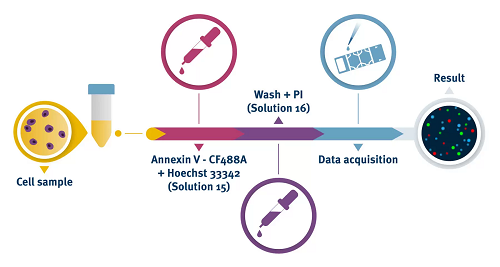
細胞膜の内膜層から外膜層へのホスファチジルセリン(PS)の転移は、アポトーシスの初期に起こり、膜の完全性の喪失やDNA断片化などの他のアポトーシス現象よりも前に起こります。アネキシンは、カルシウム依存的にリン脂質に結合する細胞内タンパク質の一種です。 アネキシンVは、PSに対する親和性が高いため、アポトーシス細胞の検出に役立つツールであることが知られおり、蛍光標識アネキシンVを使用することで、PS転移を簡単に検出できます。 アネキシンVは後期アポトーシス細胞および壊死細胞のPSにも結合する可能性がありますが、これらの細胞の膜完全性が失われているため、膜を透過しないヨウ化プロピジウムの使用により初期アポトーシス細胞と区別できます。原理
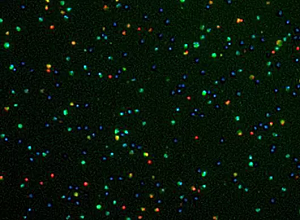 NucleoCounter®NC-3000™システムは、蛍光顕微鏡と画像解析を使用して、ホスファチジルセリンの外在化に基づいてアポトーシス細胞の検出を自動化します。 細胞をHoechst 33342、PIおよびFITC標識アネキシンVで染色します。Hoechst 33342は全細胞集団を染色し、アネキシンVはアポトーシス細胞および壊死細胞を染色します。 初期のアポトーシス細胞はPIを除外しますが、後期のアポトーシス細胞および壊死細胞はアネキシンVとPIの両方で陽性に染色されます。
NucleoCounter®NC-3000™システムは、蛍光顕微鏡と画像解析を使用して、ホスファチジルセリンの外在化に基づいてアポトーシス細胞の検出を自動化します。 細胞をHoechst 33342、PIおよびFITC標識アネキシンVで染色します。Hoechst 33342は全細胞集団を染色し、アネキシンVはアポトーシス細胞および壊死細胞を染色します。 初期のアポトーシス細胞はPIを除外しますが、後期のアポトーシス細胞および壊死細胞はアネキシンVとPIの両方で陽性に染色されます。結果はPlotManagerに表示されます。
プロットマネージャーに表示される結果
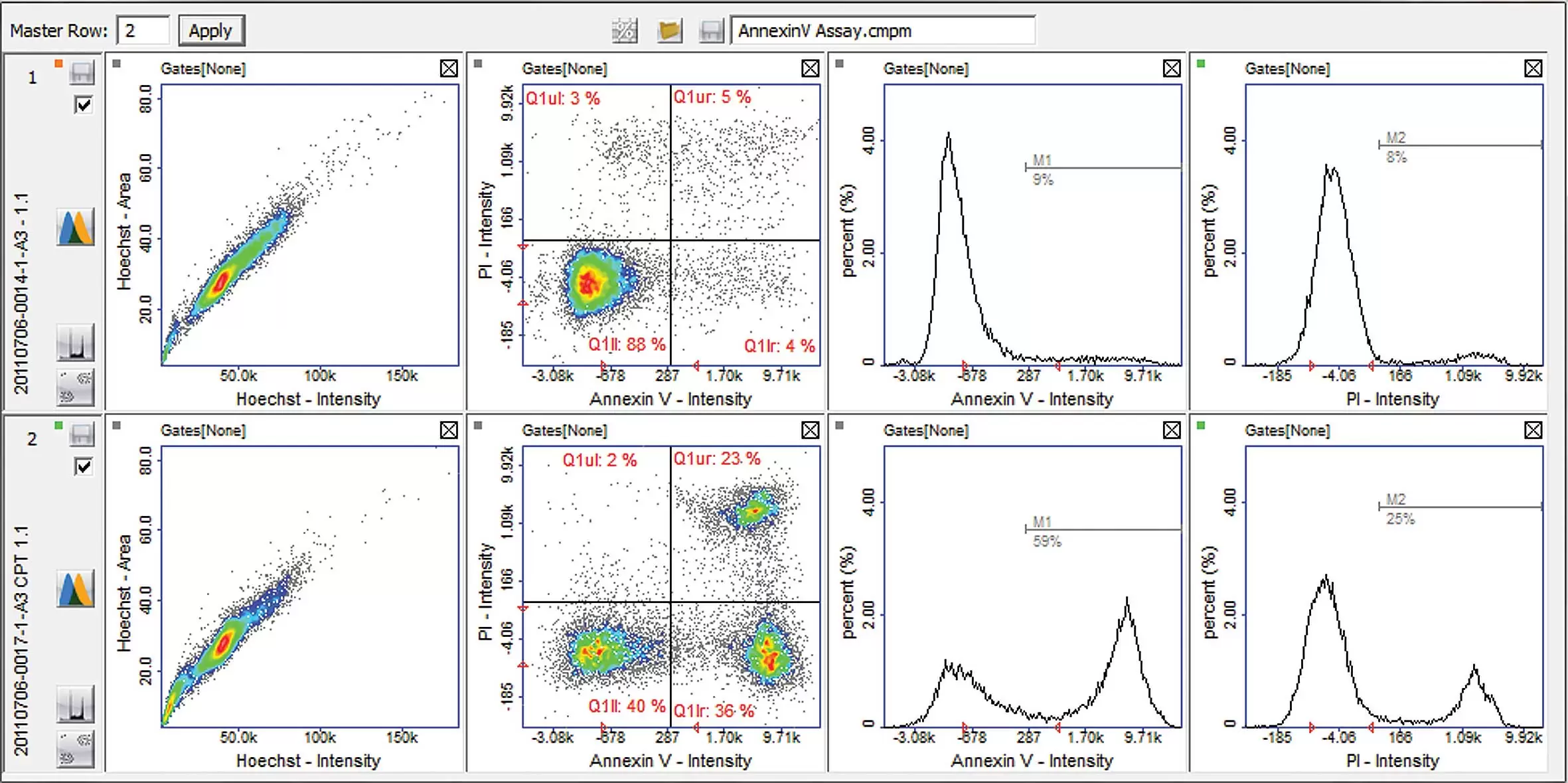
図:Jurkat細胞は、カンプトテシン(CPT)の非存在下(上段)または存在下(下段)で培養しました。 細胞をHoechst-33342、アネキシンV FITCコンジュゲートおよびヨウ化プロピジウム(PI)で染色し、NucleoCounter®NC-3000™ によって分析しました。 散布図とヒストグラムは、NucleoView™NC-3000™ソフトウェアから取得しました。 表示されたプロット中のクアドラント(B、F)とマーカー(C、D、G、H)を使用して、さまざまな細胞集団を区別しました。 この例では、カンプトテシンは初期アポトーシス細胞(アネキシンV陽性およびPI陰性細胞)の劇的な増加を引き起こしています。
消耗品
| 品番 | 品名 | 容量 | 用途 |
|---|---|---|---|
| 942-0001 | NC‐Slide A2 | 25枚 | 全アッセイ共通(NC-250・NC-3000) |
| 910-3015 | Solution 15 | 1mL | Annexin V・Caspase・GFP Transfection |
| 910-3016 | Solution 16 | 1mL | Annexin V・Caspase・GFP Transfection |
ミトコンドリア膜電位アッセイ
疎水性色素JC-1によるアポトーシスの検出特徴
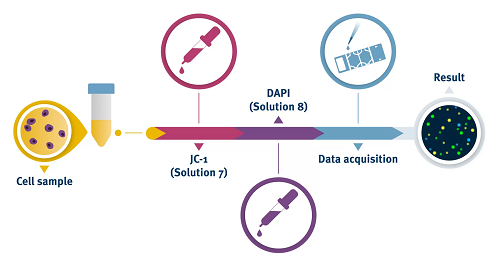
◇ 高速で自動化された解析
◇ 画像取得と解析がワンステップで可能
◇ 異なるユーザー間でも標準化された結果をもたらします
◇ キャリブレーション不要
◇ プロットマネージャーによる明確なデータ表示
◇ 自動化されたPDFレポート
◇ FCS/ACS形式でのデータエクスポート
ミトコンドリア膜電位アッセイの概要
ミトコンドリア膜電位の喪失は、アポトーシスおよび化学的低酸素症による壊死に先行することが知られています。 脂溶性カチオン色素JC-1は、ミトコンドリア内で電位依存性の蓄積を示し、健康な細胞とアポトーシス細胞を区別するための簡単な蛍光の指標として使用できます。健康な細胞では、無傷のミトコンドリア膜電位によって確立された負電荷により、ミトコンドリアマトリックスへのJC-1の蓄積が促進されます。
高濃度では、JC-1は凝集体を形成し赤色蛍光を示します。 アポトーシス細胞では、ミトコンドリアの電位が崩壊し、JC-1は単量体の緑色蛍光の形でサイトゾルに局在します。試料中の健全な細胞(赤)とアポトーシス細胞(緑)を蛍光で簡単に識別することができます。
原理
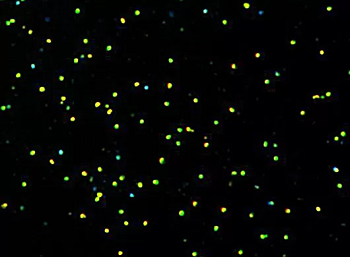 NucleoCounter NC-3000™システムは、蛍光顕微鏡法と画像解析を使用して、ミトコンドリア膜電位が崩壊した細胞の検出を自動化します。 細胞はJC-1およびDAPIで染色されます。
NucleoCounter NC-3000™システムは、蛍光顕微鏡法と画像解析を使用して、ミトコンドリア膜電位が崩壊した細胞の検出を自動化します。 細胞はJC-1およびDAPIで染色されます。細胞のJC-1モノマーと凝集体は、それぞれ緑色と赤色の蛍光として検出されます。
ミトコンドリアの脱分極は、赤色/緑色蛍光強度比の減少として検出されます。 壊死および後期アポトーシス細胞は、青色蛍光(DAPI染色)を示します。
結果はPlotManagerに表示されます。
プロットマネージャーに表示される結果
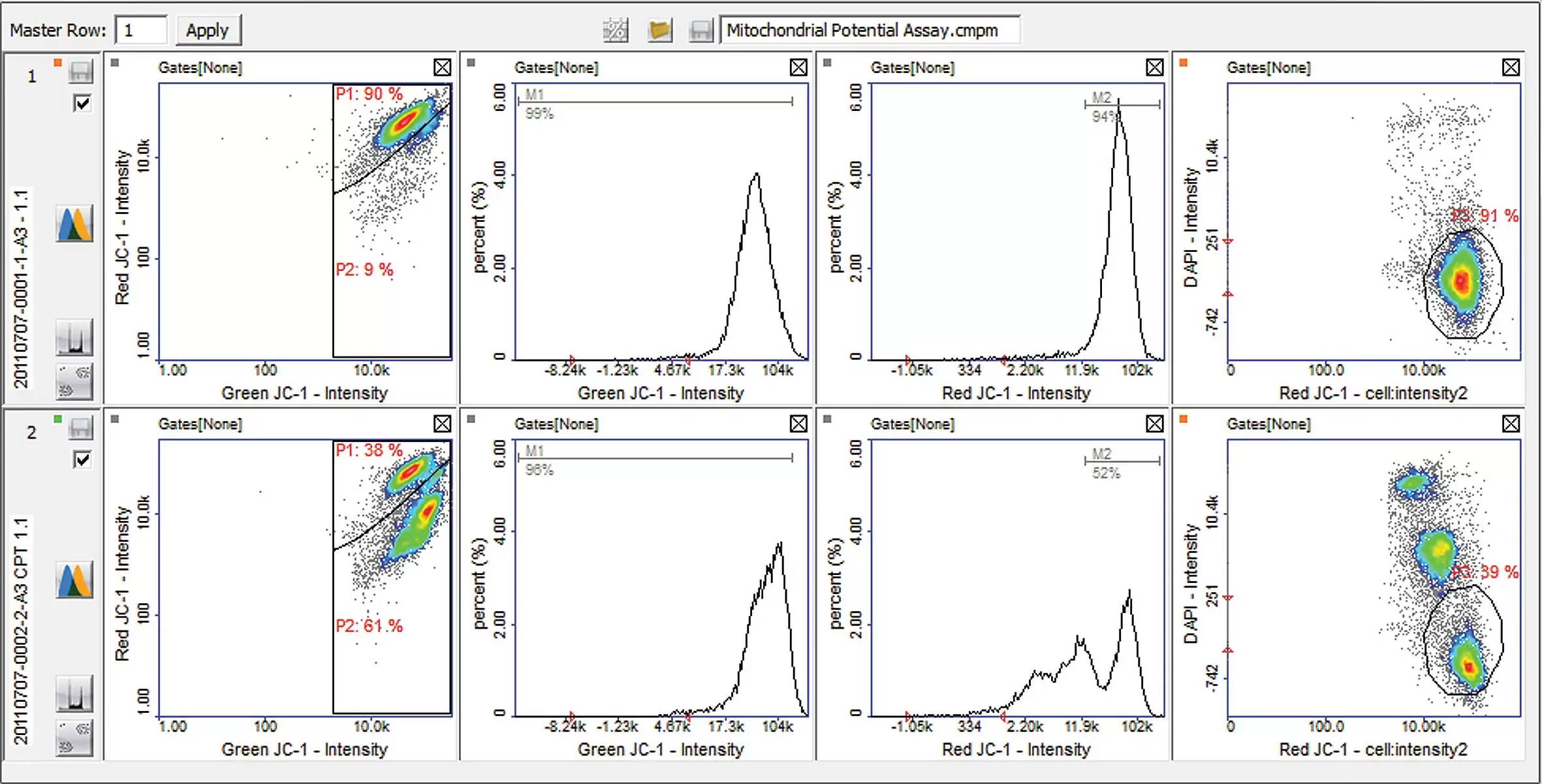
図は、Jurkat 細胞にカンプトテシン(CPT)を添加した場合の効果を示しています。CPTは、一般的に使用されるトポイソメラーゼ毒で、アポトーシスを誘導し、細胞のミトコンドリア電位を破壊します。Jurkat細胞は、ヒトTリンパ球の不死化細胞で、抗がん剤の効果を調べるためによく使用されます。
Jurkat細胞は、カンプトテシン(CPT)の非存在下(上段)または存在下(下段)で培養されました。 細胞をJC-1およびDAPIで染色し、ミトコンドリア電位アッセイおよびNucleoCounter®NC-3000™を使用して分析しました。 散布図とヒストグラムは、NucleoView™NC-3000™ソフトウェアから取得し、 表示されたプロットのポリゴンとマーカーを使用してさまざまな細胞集団を区別しました。 この例では、未処理の細胞は9%脱分極/アポトーシスであるのに対し、CPT処理細胞は61%が脱分極/アポトーシスを起こしていることがわかります。これらの結果は、CPTがミトコンドリア電位に強い影響を与えることを示唆しています。
消耗品
| 品番 | 品名 | 容量 | 用途 |
|---|---|---|---|
| 942-0001 | NC‐Slide A2 | 25枚 | 全アッセイ共通(NC-250・NC-3000) |
| 942-0003 | NC‐Slide A8 | 25枚 | 全アッセイ共通(NC-250・NC-3000) |
| 910-3007 | Solution 7 | 1mL | ミトコンドリア膜電位アッセイ |
| 910-3008 | Solution 8 | 25mL | ミトコンドリア膜電位アッセイ |
アプリケーションノート


