【ユーザーレビュー】His-tagタンパク質精製 レジン&カラム
ご協力いただいたユーザー様
ご所属:理化学研究所 放射光科学研究(SPring-8)センター 生物系ビームライン基盤グループ
(対象製品)Super Ni-NTA Agarose Resin
 ◇ His-tagタンパク質精製用ニッケルレジンです。
◇ His-tagタンパク質精製用ニッケルレジンです。◇ 市場最高クラスのタンパク質結合能と優れた薬品耐性が特徴です。
評価ポイント-①ターゲットタンパク質の回収量/ 他社製品との比較
【評価方法】500 ml 培養の大腸菌を超音波破砕後に超遠心し、上清を回収した。
Super Ni-NTA、他社製Ni-NTAレジンA、Bと上清を混合し、バッチ法により精製した。
溶出分画のタンパク質濃度(A280)の比較とSDS-PAGE(CBB染色)を行った。
【結果①】回収したタンパク質濃度
| 溶出分画 | E1(1回目の溶出液)(mg/ml) | E2(2回目の溶出液)(mg/ml) |
|---|---|---|
| 他社製品 A | 1.597 | 2.818 |
| 他社製品 B | 3.254 | 2.837 |
| Super Ni-NTA | 4.018 | 5.166 |
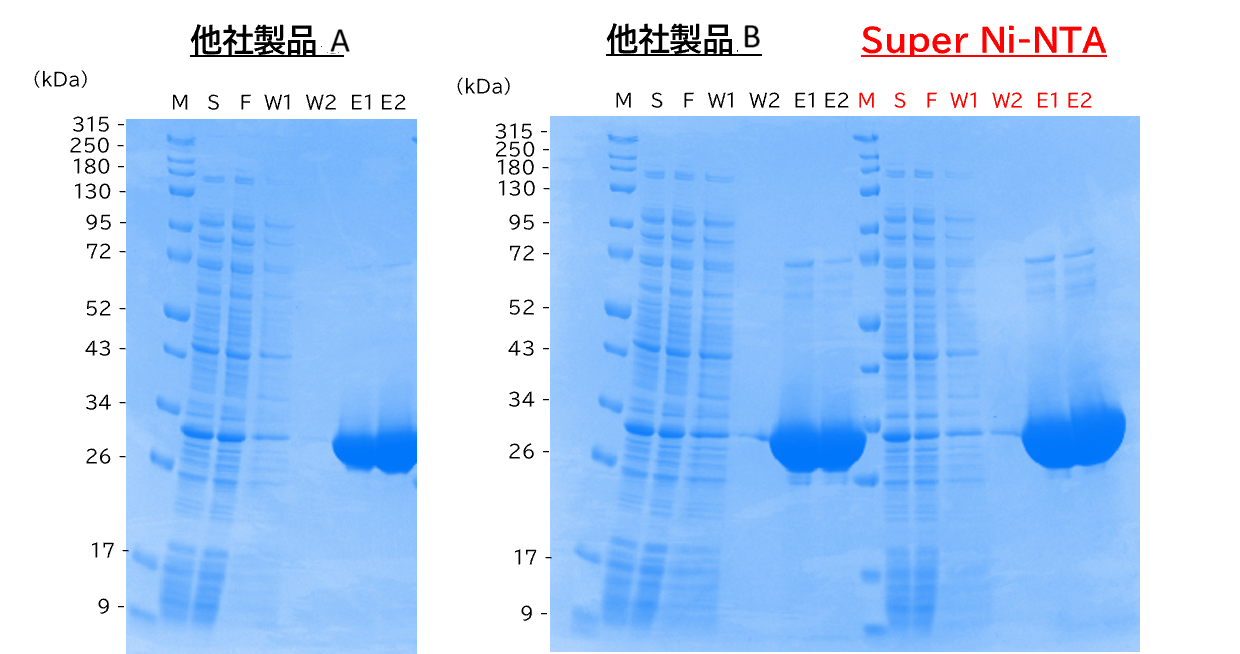
Lane
M: 分子量マーカー, S: 超遠心後の上清, F: 樹脂未吸着分,
W1: 1回目の洗浄液, W2: 2回目の洗浄液,
E1: 1回目の溶出液, E2: 2回目の溶出液
【結論①】
評価ポイント-②結合Capacityテスト
【評価方法】1 mg分のHisTag融合タンパク質とSuper Ni-NTA、他社製品A、Bの3種類の樹脂 100 µlを5分間混合し、結合していない上清のタンパク質濃度を測定した。
Binding Buffer組成:20 mM HepesNa, 350 mM NaCl, 2 mM DTT, 10 mM Imidazole
【結果②】上清に残った未結合のタンパク質濃度
| 処理前のタンパク質濃度(mg/ml) | 5分後の上清タンパク質濃度(mg/ml) | |
|---|---|---|
| 他社製品 A | 1.333 | 0.202 |
| 他社製品 B | 0.208 | |
| Super Ni-NTA | 0.170 |
【結論②】
(対象製品)HiFliQNi-NTA columns
 Super Ni-NTAレジンが充填された1 mL、5 mLのプレパックカラムです。
Super Ni-NTAレジンが充填された1 mL、5 mLのプレパックカラムです。標準的なクロマトグラフィーシステムと互換性があります。
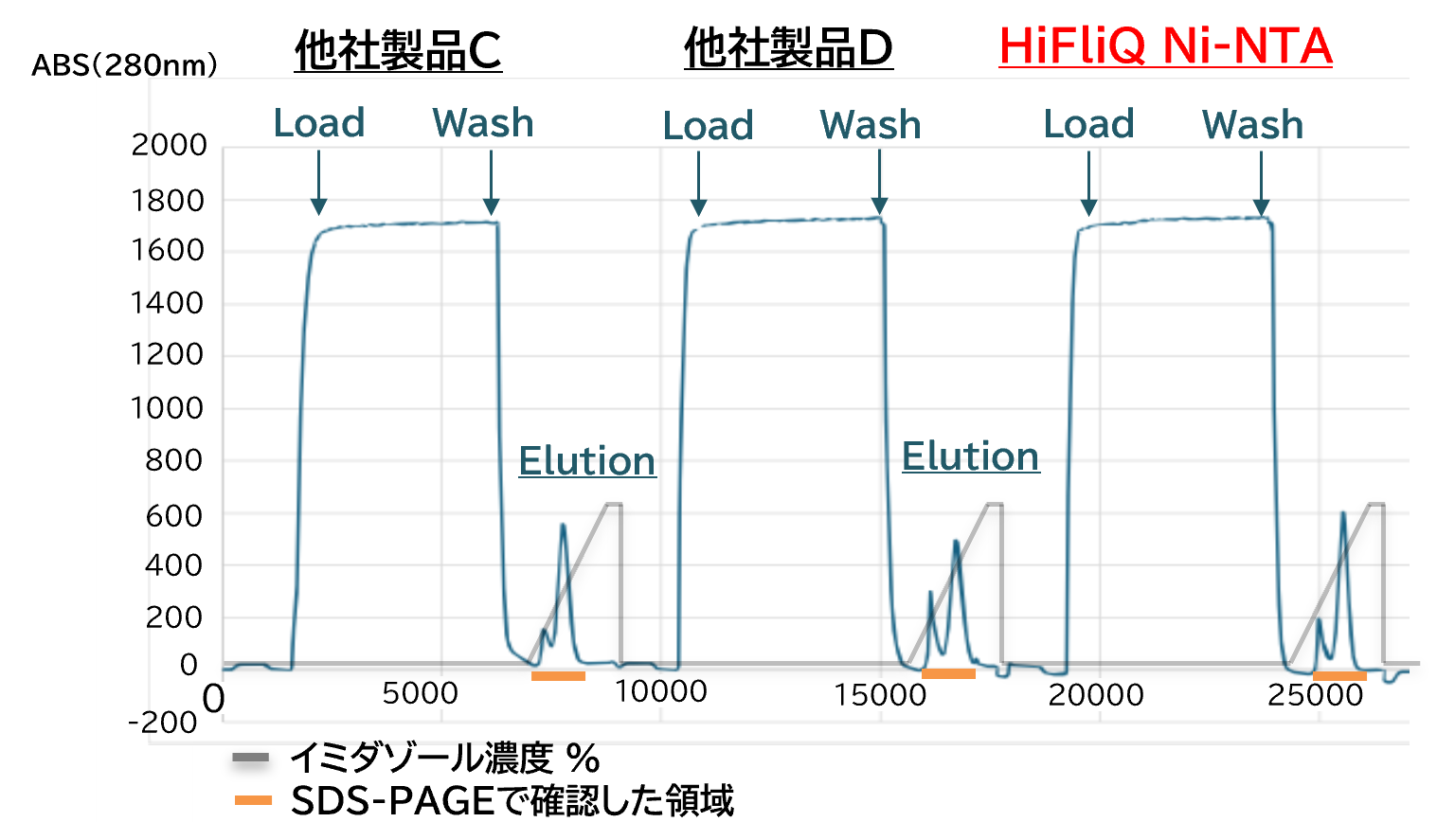
他社製品との比較データ
 |
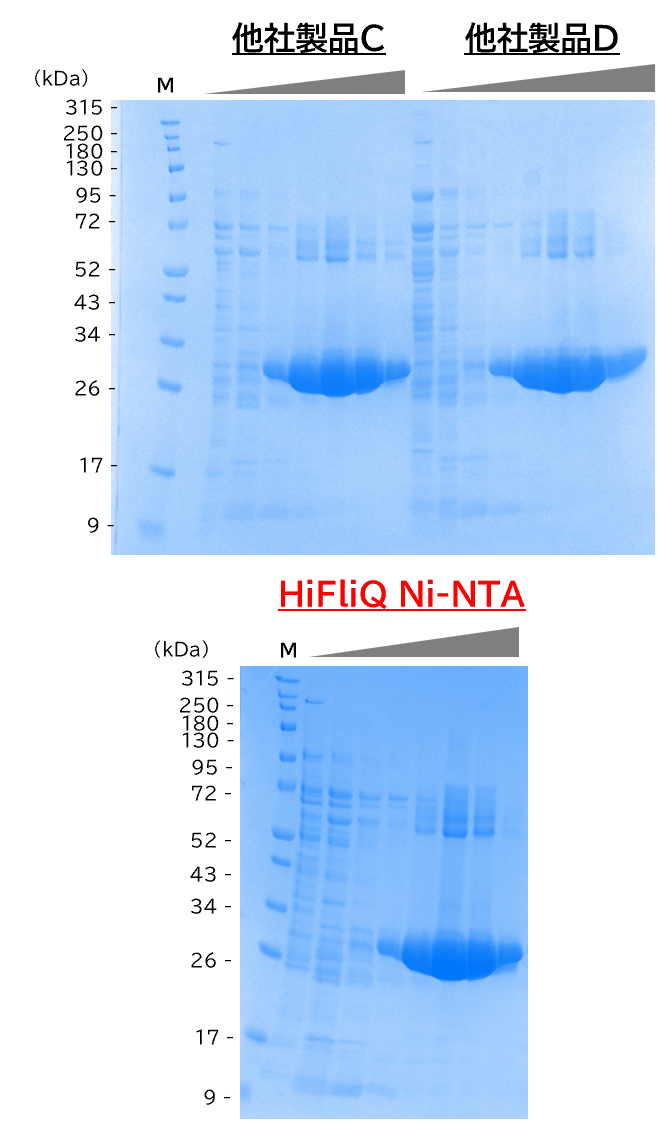 |
2 L培養の大腸菌を超音波破砕後に超遠心し、0.45 µmフィルターで濾過した。Hisタグ化タンパク質の精製はAKTA Avant(Cytiva)を使用した。
・ Wash buffer: 20 mM HEPES-Na (pH 7.0), 350 mM NaCl, 5 mM DTT
・ Elution buffer:20 mM HEPES-Na (pH 7.0), 350 mM NaCl, 5 mM DTT(50 mM~1 M Imidazole)
【結論】
アプリケーションシート

◇ 画像をクリックするとファイルが開きます。
◇ お試し用サンプルは製品ページのフォームからご依頼いただけます。
◇ 2025年価格掲載


